患者男,45岁。无明显诱因左上腹间断性疼痛15天,加重6天。患者病来偶有乏力,查体:T36.6℃,P80次/分,R16次/分,BP120/80mmHg。神清语明,全身皮肤未见出血点及瘀斑,浅表淋巴结未触及肿大,心肺腹未闻及异常。腹部平软,脾肋下约11.0cm,压痛(+),双下肢无水肿。辅助检查:血常规:白细胞4.96×10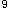 /L,淋巴细胞68.24%,血红蛋白132.0g/L,血小板59×10
/L,淋巴细胞68.24%,血红蛋白132.0g/L,血小板59×10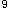 /L;彩超:脾脏增大,肋下长约11cm;LDH193U/L,Crea68μmol/L,BUN6.03mmol/L;免疫分型:CD19
/L;彩超:脾脏增大,肋下长约11cm;LDH193U/L,Crea68μmol/L,BUN6.03mmol/L;免疫分型:CD19 B淋巴细胞占:75.73%,考虑B淋巴细胞增殖性疾病。
B淋巴细胞占:75.73%,考虑B淋巴细胞增殖性疾病。
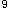 /L,淋巴细胞68.24%,血红蛋白132.0g/L,血小板59×10
/L,淋巴细胞68.24%,血红蛋白132.0g/L,血小板59×10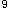 /L;彩超:脾脏增大,肋下长约11cm;LDH193U/L,Crea68μmol/L,BUN6.03mmol/L;免疫分型:CD19
/L;彩超:脾脏增大,肋下长约11cm;LDH193U/L,Crea68μmol/L,BUN6.03mmol/L;免疫分型:CD19 B淋巴细胞占:75.73%,考虑B淋巴细胞增殖性疾病。
B淋巴细胞占:75.73%,考虑B淋巴细胞增殖性疾病。 - 有关CLL的描述正确的是A.CLL多系老年发病B.CLL患者大多有淋巴结肿大C.CLL是一种多克隆性小淋巴细胞疾病D.CLL在欧美各国是最常见的白血病E.CLL绝大多数起源于T细胞F.CLL患者常出现自身免疫现象
- 此患者的骨髓象回报:骨髓增生明显活跃。无核细胞:有核细胞=1000:164,其中粒系占19.20%,红系占17.20%,粒:红=1.12:1。粒系增生减低。红系增生活跃,形态大致正常。淋巴系异常增生共占61.2%,以成熟小淋巴细胞为主,可见少量大淋巴细胞,幼淋巴细胞占4.00%。环片一周见巨核细胞164个,视片三张未见产板巨核细胞,血小板少见。结合病史、血象,骨髓象,考虑CLL。此诊断的依据包括A.外周血中持续性单克隆性淋巴细胞大于5×10
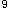 B.骨髓中小淋巴细胞≥40%C.有特征性的染色体t(11;14)D.CD43
B.骨髓中小淋巴细胞≥40%C.有特征性的染色体t(11;14)D.CD43 、CD5
、CD5 、CD19
、CD19 、CD23
、CD23 E.小鼠玫瑰花结试验阴性F.血象中淋巴细胞形态正常
E.小鼠玫瑰花结试验阴性F.血象中淋巴细胞形态正常 - CLL患者预后较差的染色体核型包括A.12号染色体三体B.11q
 C.17p
C.17p D.单纯13q
D.单纯13q E.正常核型F.Ph+
E.正常核型F.Ph+ - 关于CLL的实验室检查正确的是A.骨髓象淋巴细胞≥30%B.外周血涂片中破损细胞增多C.骨髓红系、粒系及巨核系细胞均减少D.骨髓象以幼稚淋巴细胞为主E.骨髓浸润呈弥漫型时骨髓内常残存部分正常造血F.无IgVH突变者预后较差
- 下列情况应该开始化疗的是A.体重减少5%B.进行性淋巴细胞增生2个月内增加>10%C.发热(38℃)>2周D.进行性脾大E.贫血或血小板减少加重F.对激素治疗有效
- 有关CLL的治疗不正确的是A.应用烷化剂期间需每周检查血象,调整药物剂量,以防骨髓过度抑制B.烷化剂治疗初治CLL可获得较高的缓解率C.COP或CHOP联合方案化疗优于单药治疗D.可应用嘌呤类似物联合烷化剂治疗难治复发CLLE.Campath-1H对p53缺失者有疗效F.FCR方案治疗初治CLL最佳
正确答案:
(1)ABDF
(2)ABD
(3)ABC
(4)BCF
(5)CDE
(6)BCG
(2)ABD
(3)ABC
(4)BCF
(5)CDE
(6)BCG
答案解析:
1.慢性淋巴细胞白血病(CLL)是一种单克隆性小淋巴细胞疾病。CLL绝大多数起源于B细胞,T细胞者较少。本病在欧美各国是最常见的白血病。患者多系老年,90%的患者在50岁以上发病,中位年龄65岁,男女比例2:1。起病缓慢,多无自觉症状。60%~80%患者有淋巴结肿大,50%~70%患者有轻至中度脾大,轻度肝大,但胸骨压痛少见。由于免疫功能减退,常易并发感染。也常出现自身免疫现象,如Evans综合征、自身免疫性溶血性贫血(AIHA)、免疫性血小板减少性紫癜(ITP)等。终末期可出现幼淋巴细胞白血病(PLL)、Richter综合征(转化为弥漫大B细胞淋巴瘤等)和第二肿瘤。
2.结合临床表现,外周血中持续性单克隆性淋巴细胞大于5×10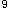 /L,骨髓中小淋巴细胞≥40%,以及根据免疫学表面标志,可以作出慢性淋巴细胞白血病的诊断和分类。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。淋巴细胞具有单克隆性,源于B细胞者,小鼠玫瑰花结试验阳性,SmIg弱阳性(IgM或IgM和IgD),CD5、CD19、CD23、CD43、CD79α阳性。
/L,骨髓中小淋巴细胞≥40%,以及根据免疫学表面标志,可以作出慢性淋巴细胞白血病的诊断和分类。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。淋巴细胞具有单克隆性,源于B细胞者,小鼠玫瑰花结试验阳性,SmIg弱阳性(IgM或IgM和IgD),CD5、CD19、CD23、CD43、CD79α阳性。
3.80%的CLL患者有染色体异常。预后较好的染色体核型为单纯13q (50%)和正常核型;预后较差的染色体核型包括12号染色体三体(20%)、11q
(50%)和正常核型;预后较差的染色体核型包括12号染色体三体(20%)、11q (20%)和17p
(20%)和17p (10%)。
(10%)。
4.CLL的实验室检查:(1)血象:持续淋巴细胞增多。白细胞>10×10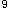 /L,淋巴细胞占50%以上,绝对值≥5×10
/L,淋巴细胞占50%以上,绝对值≥5×10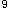 /L(持续4周以上)。大多数患者白血病细胞形态与成熟小淋巴细胞相同,胞浆少,胞核染色质呈凝块状;少数患者淋巴细胞形态异常,胞体较大,不成熟,胞核有深切迹(Reider细胞);偶可见原始淋巴细胞。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。(2)骨髓象:有核细胞增生明显活跃或极度活跃,淋巴细胞≥40%,以成熟淋巴细胞为主。红系、粒系及巨核系细胞均减少,伴有溶血时,幼红细胞可代偿性增生。骨髓活检白血病细胞对骨髓的浸润可呈弥漫型、结节型、间质型和结节间质混合型,后三种情况下骨髓内常残存部分正常造血。(3)基因突变:50%~60%的CLL发生免疫球蛋白重链可变区(IgVH)基因体细胞突变,IgVH突变发生于经历了抗原选择的记忆B细胞(后生发中心),此类病例生存期长;无IgVH突变者预后较差,此类CLL起源于未经抗原选择的原始B细胞(前生发中心)。IgVH基因突变与CD38、ZAP70表达呈负相关。约10%的CLL存在p53缺失。
/L(持续4周以上)。大多数患者白血病细胞形态与成熟小淋巴细胞相同,胞浆少,胞核染色质呈凝块状;少数患者淋巴细胞形态异常,胞体较大,不成熟,胞核有深切迹(Reider细胞);偶可见原始淋巴细胞。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。(2)骨髓象:有核细胞增生明显活跃或极度活跃,淋巴细胞≥40%,以成熟淋巴细胞为主。红系、粒系及巨核系细胞均减少,伴有溶血时,幼红细胞可代偿性增生。骨髓活检白血病细胞对骨髓的浸润可呈弥漫型、结节型、间质型和结节间质混合型,后三种情况下骨髓内常残存部分正常造血。(3)基因突变:50%~60%的CLL发生免疫球蛋白重链可变区(IgVH)基因体细胞突变,IgVH突变发生于经历了抗原选择的记忆B细胞(后生发中心),此类病例生存期长;无IgVH突变者预后较差,此类CLL起源于未经抗原选择的原始B细胞(前生发中心)。IgVH基因突变与CD38、ZAP70表达呈负相关。约10%的CLL存在p53缺失。
5.早期(Rai分期0~Ⅱ期或Binet分期A期)患者无需治疗,定期复查即可。出现下列情况说明疾病高度活动,应开始化疗:①体重减少≥10%、极度疲劳、发热(38℃)>2周、盗汗;②进行性脾肿大或脾区疼痛;③淋巴结进行性肿大或直径>10cm;④进行性淋巴细胞增生,2个月内增加>50%,或倍增时间<6个月;⑤激素治疗后,自身免疫性贫血或血小板减少反应较差;⑥骨髓进行性衰竭;贫血或血小板减少出现或加重。在疾病进展期(Ⅲ、Ⅳ期或C期),却无疾病进展表现者,有时也可"观察和等待"。
6.CLL的治疗:(1)化学治疗:苯丁酸氮芥(chlorambucil,CLB)是烷化剂,连续用药剂量为4~8mg/(m ·d),连用4~8周。其间需每周检查血象,调整药物剂量,以防骨髓过度受抑制。对初治CLL,烷化剂的临床缓解率不足10%。COP或CHOP联合方案化疗并不优于单药治疗。烷化剂耐药者换用Flu仍有效。嘌呤类似物联合烷化剂,如Flu联合环磷酰胺(FC),优于单用Flu,能有效延长初治CLL的无进展生存期,并成为治疗难治复发CLL的化疗方案之一。(2)免疫治疗:p53缺失者对烷化剂、嘌吟类药物及CD20单抗耐药,而Campath-1H对其仍有疗效。Campath-1H能够清除血液和骨髓内的CLL细胞,也可考虑用于维持治疗。(3)化学免疫治疗:FC联合Rituximab(FCR)治疗初治CLL,获得临床缓解率70%,总应答率95%,40%以上临床缓解患者的骨髓中PCR检测未发现微小残留病,4年无治疗失败生存率为69%。这是初治CLL迄今获得的最佳治疗反应。(4)HSCT:在缓解期行自体干细胞移植治疗CLL效果优于传统化疗,患者体内的微小残留病可转阴,但随访至4年时,50%复发。
·d),连用4~8周。其间需每周检查血象,调整药物剂量,以防骨髓过度受抑制。对初治CLL,烷化剂的临床缓解率不足10%。COP或CHOP联合方案化疗并不优于单药治疗。烷化剂耐药者换用Flu仍有效。嘌呤类似物联合烷化剂,如Flu联合环磷酰胺(FC),优于单用Flu,能有效延长初治CLL的无进展生存期,并成为治疗难治复发CLL的化疗方案之一。(2)免疫治疗:p53缺失者对烷化剂、嘌吟类药物及CD20单抗耐药,而Campath-1H对其仍有疗效。Campath-1H能够清除血液和骨髓内的CLL细胞,也可考虑用于维持治疗。(3)化学免疫治疗:FC联合Rituximab(FCR)治疗初治CLL,获得临床缓解率70%,总应答率95%,40%以上临床缓解患者的骨髓中PCR检测未发现微小残留病,4年无治疗失败生存率为69%。这是初治CLL迄今获得的最佳治疗反应。(4)HSCT:在缓解期行自体干细胞移植治疗CLL效果优于传统化疗,患者体内的微小残留病可转阴,但随访至4年时,50%复发。
2.结合临床表现,外周血中持续性单克隆性淋巴细胞大于5×10
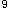 /L,骨髓中小淋巴细胞≥40%,以及根据免疫学表面标志,可以作出慢性淋巴细胞白血病的诊断和分类。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。淋巴细胞具有单克隆性,源于B细胞者,小鼠玫瑰花结试验阳性,SmIg弱阳性(IgM或IgM和IgD),CD5、CD19、CD23、CD43、CD79α阳性。
/L,骨髓中小淋巴细胞≥40%,以及根据免疫学表面标志,可以作出慢性淋巴细胞白血病的诊断和分类。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。淋巴细胞具有单克隆性,源于B细胞者,小鼠玫瑰花结试验阳性,SmIg弱阳性(IgM或IgM和IgD),CD5、CD19、CD23、CD43、CD79α阳性。3.80%的CLL患者有染色体异常。预后较好的染色体核型为单纯13q
 (50%)和正常核型;预后较差的染色体核型包括12号染色体三体(20%)、11q
(50%)和正常核型;预后较差的染色体核型包括12号染色体三体(20%)、11q (20%)和17p
(20%)和17p (10%)。
(10%)。4.CLL的实验室检查:(1)血象:持续淋巴细胞增多。白细胞>10×10
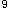 /L,淋巴细胞占50%以上,绝对值≥5×10
/L,淋巴细胞占50%以上,绝对值≥5×10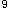 /L(持续4周以上)。大多数患者白血病细胞形态与成熟小淋巴细胞相同,胞浆少,胞核染色质呈凝块状;少数患者淋巴细胞形态异常,胞体较大,不成熟,胞核有深切迹(Reider细胞);偶可见原始淋巴细胞。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。(2)骨髓象:有核细胞增生明显活跃或极度活跃,淋巴细胞≥40%,以成熟淋巴细胞为主。红系、粒系及巨核系细胞均减少,伴有溶血时,幼红细胞可代偿性增生。骨髓活检白血病细胞对骨髓的浸润可呈弥漫型、结节型、间质型和结节间质混合型,后三种情况下骨髓内常残存部分正常造血。(3)基因突变:50%~60%的CLL发生免疫球蛋白重链可变区(IgVH)基因体细胞突变,IgVH突变发生于经历了抗原选择的记忆B细胞(后生发中心),此类病例生存期长;无IgVH突变者预后较差,此类CLL起源于未经抗原选择的原始B细胞(前生发中心)。IgVH基因突变与CD38、ZAP70表达呈负相关。约10%的CLL存在p53缺失。
/L(持续4周以上)。大多数患者白血病细胞形态与成熟小淋巴细胞相同,胞浆少,胞核染色质呈凝块状;少数患者淋巴细胞形态异常,胞体较大,不成熟,胞核有深切迹(Reider细胞);偶可见原始淋巴细胞。多数患者外周血涂片中可见破损细胞(涂抹细胞或"篮细胞"),该种细胞增多是CLL血象特征。(2)骨髓象:有核细胞增生明显活跃或极度活跃,淋巴细胞≥40%,以成熟淋巴细胞为主。红系、粒系及巨核系细胞均减少,伴有溶血时,幼红细胞可代偿性增生。骨髓活检白血病细胞对骨髓的浸润可呈弥漫型、结节型、间质型和结节间质混合型,后三种情况下骨髓内常残存部分正常造血。(3)基因突变:50%~60%的CLL发生免疫球蛋白重链可变区(IgVH)基因体细胞突变,IgVH突变发生于经历了抗原选择的记忆B细胞(后生发中心),此类病例生存期长;无IgVH突变者预后较差,此类CLL起源于未经抗原选择的原始B细胞(前生发中心)。IgVH基因突变与CD38、ZAP70表达呈负相关。约10%的CLL存在p53缺失。5.早期(Rai分期0~Ⅱ期或Binet分期A期)患者无需治疗,定期复查即可。出现下列情况说明疾病高度活动,应开始化疗:①体重减少≥10%、极度疲劳、发热(38℃)>2周、盗汗;②进行性脾肿大或脾区疼痛;③淋巴结进行性肿大或直径>10cm;④进行性淋巴细胞增生,2个月内增加>50%,或倍增时间<6个月;⑤激素治疗后,自身免疫性贫血或血小板减少反应较差;⑥骨髓进行性衰竭;贫血或血小板减少出现或加重。在疾病进展期(Ⅲ、Ⅳ期或C期),却无疾病进展表现者,有时也可"观察和等待"。
6.CLL的治疗:(1)化学治疗:苯丁酸氮芥(chlorambucil,CLB)是烷化剂,连续用药剂量为4~8mg/(m
 ·d),连用4~8周。其间需每周检查血象,调整药物剂量,以防骨髓过度受抑制。对初治CLL,烷化剂的临床缓解率不足10%。COP或CHOP联合方案化疗并不优于单药治疗。烷化剂耐药者换用Flu仍有效。嘌呤类似物联合烷化剂,如Flu联合环磷酰胺(FC),优于单用Flu,能有效延长初治CLL的无进展生存期,并成为治疗难治复发CLL的化疗方案之一。(2)免疫治疗:p53缺失者对烷化剂、嘌吟类药物及CD20单抗耐药,而Campath-1H对其仍有疗效。Campath-1H能够清除血液和骨髓内的CLL细胞,也可考虑用于维持治疗。(3)化学免疫治疗:FC联合Rituximab(FCR)治疗初治CLL,获得临床缓解率70%,总应答率95%,40%以上临床缓解患者的骨髓中PCR检测未发现微小残留病,4年无治疗失败生存率为69%。这是初治CLL迄今获得的最佳治疗反应。(4)HSCT:在缓解期行自体干细胞移植治疗CLL效果优于传统化疗,患者体内的微小残留病可转阴,但随访至4年时,50%复发。
·d),连用4~8周。其间需每周检查血象,调整药物剂量,以防骨髓过度受抑制。对初治CLL,烷化剂的临床缓解率不足10%。COP或CHOP联合方案化疗并不优于单药治疗。烷化剂耐药者换用Flu仍有效。嘌呤类似物联合烷化剂,如Flu联合环磷酰胺(FC),优于单用Flu,能有效延长初治CLL的无进展生存期,并成为治疗难治复发CLL的化疗方案之一。(2)免疫治疗:p53缺失者对烷化剂、嘌吟类药物及CD20单抗耐药,而Campath-1H对其仍有疗效。Campath-1H能够清除血液和骨髓内的CLL细胞,也可考虑用于维持治疗。(3)化学免疫治疗:FC联合Rituximab(FCR)治疗初治CLL,获得临床缓解率70%,总应答率95%,40%以上临床缓解患者的骨髓中PCR检测未发现微小残留病,4年无治疗失败生存率为69%。这是初治CLL迄今获得的最佳治疗反应。(4)HSCT:在缓解期行自体干细胞移植治疗CLL效果优于传统化疗,患者体内的微小残留病可转阴,但随访至4年时,50%复发。专业实践能力
